} Energi kimia yang terkandung dalam suatu zat adalah semacam energi potensial dari suatu zat tersebut.
}Energi potensial kimia yang terkandung dalam suatu zat disebut entalpi dan dinyatakan dalam simbol H.
} Selisih antara entalpi reaktan dan entalpi hasil suatu reaksi disebut perubahan entalpi reaksi
} Satuan yang sering digunakan untuk menyatakan jumlah panas yang diserap atau dibebaskan adalah kalori atau joule. 1 Kalori = 4,186 Joule
Reaksi Eksoterm
} Reaksi yang membebaskan panas sebesar
ΔH. Apabila
perubahan entalpi reaksi negatif (ΔH = -)

Reaksi Endoterm
} Reaksi menyerap panas sebesar ΔH
} Perubahan entalpi reaksi bernilai
positif (ΔH
= +)
Macam-Macam ΔH – ΔH Pembentukan
} Yaitu panas yang dikeluarkan atau
diperlukan untuk membentuk 1 mol senyawa dari unsur-unsur nya
} Contoh : Reaksi
pembentukan air
ΔHf = -68,3 kkal/mol
Artinya : perubahan entalpi pembentukan air dalam fasa cair
adalah -68.3 kkal
Macam-Macam ΔH – ΔH Penguraian
} Yaitu panas yang dikeluarkan atau
diperlukan untuk menguraikan 1 mol senyawa menjadi unsur-unsurnya
} Contoh : Reaksi
penguraian air
ΔH = +68,3 kkal/mol
Artinya :
perubahan entalpi penguraian air = +68.3 kkal/mol
Macam-Macam ΔH – ΔH Pembakaran
} Yaitu panas yang dikeluarkan pada pembakaran 1 mol unsur atau
sneyawa
ΔH = -212,4 kkal/mol
Artinya :
perubahan entalpi pembakaran metana adalah -212,4 kkal/mol
Hukum pada Termokimia – Hukum Laplace
} Berbunyi “ Jumlah kalor yang
dilepaskan pada pembentukan suatu senyawa dari unsur-unsurnya sama dengan
jumlah kalor yang diperlukan untuk menguraikan senyawa itu menjadi
unsur-unsurnya
Contoh
Hukum pada Termokimia – Hukum Hess
} Berbunyi “ Bila suatu perubahan kimia
dapat dibuat menjadi beberapa jalan/cara yang berbeda, jumlah perubahan energi
panas keseluruhan (total) adalah tetap, tidak bergantung pada jalan/cara yang
ditempuh”
} ΔH untuk unsur bebas maupun gas adalah nol (pada kondisi STP)
Penentuan entalpi pembakaran berdasarkan entalpi tiap senyawa
ΔHf
= ?
Apabila diketahui ΔHf untuk X, Y,Z dan W, maka
Energi Ikatan
} Energi ikatan adalah energi yang
diperlukan untuk memutuskan ikatan kimia dalam 1 mol senyawa dalam wujud gas
pada keadaan standar menjadi atom-atom gasnya. Energi ikatan sering disebut
entalpi ikatan
Penentuan entalpi berdasarkan energi
ikatan
CH3OH(g) + ½
O2(g) → HCHO(g) + H2O(g)
- Lakukan rancangan ikatan unsur nya
- Lihat tabel untuk energi ikatan antar unsur
- Perhatikan koefisien reaksi sebagai faktor pengali
- Kelompokkan energi ikatan untuk pereaksi dan hasil reaksi

Diketahui energi ikatan rata-rata dari C–H = 415 kJ;
C–O = 356 kJ; O–H = 463 kJ; O=O = 498, 3 kJ; dan C=O = 724 kJ. Maka tentukan
entalpi dari reaksi di atas.







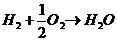

















0 komentar:
Posting Komentar