— Sel volta adalah salah satu upaya
untuk mengukur gaya dorong suatu reaksi oksidasi-reduksi dan bagaimana cara
membandingkan dengan gaya dorong reaksi lain.
— Sel volta adalah penataan kimia bahan
kimia dan penghantar listrik yang memberikan aliran elektron lewat rangkaian
luar dari suatu zat kimia yang teroksidasi ke zat kimia yang yang direduksi
— Dalam konsep sel volta, oksidasi
berarti dilepaskannya elektron oleh atom, molekul atau ion; dan reduksi berarti
diperolehnya elektron oleh partikel-partikel ini
Terdapat
reaksi spontan apabila zink dibenamkan dalam larutan tembaga sulfat, lembaran
zink akan melarut dan dibebaskan energi panas.
Reaksi
keseluruhan: Zn + CuSO4
--------------- ZnSO4 + Cu
Reaksi yang
sebenarnya adalah antara ion zink dan tembaga:
Zn + Cu2+ --------------- Zn2+
+ Cu
Tiap atom
zink kehilangan 2 elektron unutk menjadi sebuah ion zink dan tiap ion tembaga
akan memperoleh 2 elektron untuk menjadi atom tembaga
oksidasi: Zn ------------ Zn2+ +2e-
reduksi: Cu2+ + 2e-
----------- Cu
Contoh lain
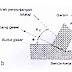
— Rangkaian yang pertama tidak
memungkinkan terukurnya arus
— Apabila zink tidak bersentuhan
langsung dengan larutan tembaga maka masih ada kemungkinan memperoleh suatu
reaksi Zn dengan Cu2+ dgn sistem rangkaian seperti gb berikut.
— Penataan ini memungkinkan (1) aliran
elektron melewati suatu penghantar dari atom zink ke ion tembaga; (2) difusi
ion positif dan ion negatif sehingga larutan tetap netralc
Mekanisme
— Elektron valensi mengalir dari atom
zink ke kawat penghantar dan dengan terbentuknya ion-ion Zn2+ ini
memasuki larutan dan berdifusi menjauhi lembaran zink:
Zn
---------- Zn2+ + 2e-
— Ion negatif berdifusi lewat jembatan
garam menuju elektrode zink. Pada waktu tertentu akan diamati lembaran zink
akan menghilang karena habis
— Elektron yang dilepaskan oleh atom
zink memasuki kawat penyambung dan menyebabkan elektron-elektron pada ujung
yang lain berkumpul pada permukaan elektrode tembaga membentuk atom tembaga:
Cu2+ + 2e----------
Cu
— Pada waktu tertentu elektrode tembaga
logam akan makin membesar dan warna biru larutan tembaga sulfat akan memucat
karena konsentrasi ion tembaga berkurang
— Secara keseluruhan sementara reaksi
berjalan terdapat gerakan ion positif menuju tembaga dan ion negatif menuju
zink
— Suatu baterai dimana terdapat zink,
zink sulfat, tembaga dan tembaga sulfat biasa disebut sel Daniell. Karena
aliran elektron lewat rangkaian luar membentuk suatu arus listrik maka reaksi
antara zink dan tembaga dapat dikendalikan untuk menghasilkan tenaga listrik
— Elektrode tempat berlangsungnya
reaksi oksidasi disebut anode
Sedangkan reaksi reduksi terjadi pada elektrode
katode 



















0 komentar:
Posting Komentar